
Luis Torres Pérez, Mónica Rodríguez Bouza, Ana María Leal Valle, Jesús Bujalance Hoyos and Cipriano Viñas Vera
Leitura Crítica: Tratamento do Vómito
Abstract: Resumo É realizada a revisão de um artigo de revisão
crítica tendo como base a seguinte pergunta: O ondansetron é o fármaco
de referência para abordar a gastroenterite aguda nas urgências
pediátricas? Foi selecionado o artigo de Freedman (Freedman et al.,
2006). Os resultados indicam um déficit a nível da metodologia
utilizada para comparar o ondansetron com um placebo.
Keywords: Ondansetron; Tratamento de Emergência; Placebo
ENFOQUE DEL PROBLEMA
Apesar de se recomendar a terapia de reidratação oral para
crianças com desidratação ligeira a moderada, esta continua a ser
infrautilizada. Os médicos que prestam cuidados nos serviços de
urgências são mais propensos a escolherem a via intravenosa durante
a reidratação oral quando o vómito é um sintoma importante. Num
inquérito, 36% dos pediatras afirmou que o vómito era uma
contraindicação para a reidratação oral. Portanto, é provável que um
método seguro e eficaz para controlar o vómito aumente a taxa de
utilização e o êxito da reidratação oral, o que agiliza a abordagem
nas urgências e reduz a pressão nestas unidades uma vez que se pode
dar alta à criança com maior celeridade e segurança.
Um dos medicamentos de escolha devido ao seu potente efeito
antiemético é o ondansetron, mas diversos estudos questionavam a sua
indicação em doentes pediátricos, desde a possibilidade de gerar
arritmias cardíacas, até ao potencial para causar diarreia, o que se
converte numa contraindicação relativa em quadros em que este seja o
sintoma predominante, acompanhado de vómitos. Situação muito
frequente na abordagem das GEA nos serviços de urgências tanto
pediátricos como de doentes adultos.
Deveria colocar-se a questão de se o ondansetron é o fármaco de
referência para abordar a gastroenterite aguda nas urgências
pediátricas
(Freedman, Adler, Seshadri, & Powell, 2006).
Para isso, nos voltamos para o desenho da questão clínica no formato PICO no
Tabela 1:
Tabela 1.
|
Problema (P) |
Intervenção (I) |
Comparação (C) |
Resultado (O) |
| Abordagem geral |
Tratamento do vómito em crianças |
Administração do ondansetron |
Placebo |
Redução da presença e frequência dos vómitos, melhor
ingestão oral, menor necessidade de reposição intravenosa |
| Abordagem específica |
Tratamento do vómito em crianças com GEA entre 6 meses e
10 anos (nas urgências) |
Administração do ondansetron oral (comprimidos de
dissolução oral) |
Placebo (mesmo formato) |
|
VAMOS RESPONDER À PERGUNTA
Com base nesta pergunta, procurámos a evidência nas fontes de
referência e encontrámos o artigo de Freedman (Freedman et al.,
2006), publicado numa revista de muito alto impacto. Para além
disso, este autor continuou a publicar esta linha e é citado em
várias revisões sistemáticas, incluindo a da AAP.
Uma leitura rápida do artigo, centrada no resumo, constata umas
conclusões muito prometedoras, e que parecem encaixar na nossa
pergunta: “Nas crianças com gastroenterite e desidratação, uma dose
única de ondansetron oral reduz os vómitos e facilita a reidratação
oral e, por isso, pode ser muito adequado para ser usado no serviço
de urgências”. Mas, quando se revê a metodologia, contata-se que:
“Foram incluídas 215 crianças de 6 meses a 10 anos de idade que
foram tratadas num serviço de urgências pediátricas quanto a
gastroenterite e desidratação. Depois de serem selecionadas
aleatoriamente para tratamento com comprimidos de dissolução oral de
ondansetron ou placebo”. E nos resultados assinala-se que: “Em
comparação com as crianças que receberam o placebo, as crianças que
receberam o ondansetron eram menos propensas a vomitar (14% em
comparação com 35%; risco relativo, 0,40; intervalo de confiança de
95%, 0,26 a 0,61), vomitavam com menos frequência (número de
episódios por criança significaria, 0,18 vs. 0,65; p<0,001),
tinham uma maior ingestão oral (239 ml vs 196 ml, p = 0,001), e eram
menos propensas a serem tratadas por meio de reidratação intravenosa
(14% em comparação com 31%; risco relativo, 0,46; intervalo de
confiança de 95%, 0,26 a 0,79)”.
Há, pois, uma diferença clara a favor do medicamento, comparado
com o placebo. Esta é a resposta que queremos?
LEITURA CRÍTICA SEM PRETENSÕES
A «qualidade global» de um estudo de investigação clínica é um
conceito complexo que inclui:
-
O primeiro aspeto é a pertinência clínica, entendendo-se como
tal que se trate de perguntas e, sobretudo, de resultados de
investigação úteis para a decisão clínica
-
O segundo aspeto é a «qualidade metodológica» ou em que
medida o desenho, a realização e a análise minimizam os vieses
de seleção, medição e confusão, ou seja, em que medida é válido
o estudo ou, dito de outra forma, até que ponto acreditamos nos
resultados.
-
O terceiro aspeto é a aplicabilidade ou transferibilidade do
resultado a um doente concreto (ou grupo de doentes),
considerando os outros elementos que influenciam a aplicação
desta evidência («representatividade» dos doentes do ECA,
relação riscos/benefícios, disponibilidade, valores do doente,
custos, etc.).
Um dos aspetos fundamentais, e que foi assinalado como “duvidoso”
na leitura, é a COMPARAÇÃO. Neste aspeto está, sem dúvida, a chave
prática e ética dos ECA. Do ponto de vista do clínico prático, só
faz sentido comparar novas intervenções com intervenções com efeitos
já comprovados, ou pelo menos que sejam os tratamentos usuais; não
usar tratamentos comprovados seria ilícito e, para além disso, essa
comparação reproduziria o possível dilema decisional real (novo
tratamento em comparação com o tratamento habitual).
A intervenção comparativa reflete o ponto de atrito entre duas
dialéticas diferentes: a da prática clínica e a da investigação
clínica e é, portanto, uma questão crucial que condiciona o desenho
de várias maneiras.
Em primeiro lugar, requer um conhecimento explícito do estado do
tratamento para a condição ou cenário clínico em questão
(preferencialmente por meio de uma RS). Em segundo lugar, a
existência de tratamentos eficazes limita o uso do placebo como
técnica de investigação e obriga a incluí-los nas comparações.
E aqui está a dúvida: existem outros tratamentos antieméticos
conhecidos e de uso frequente no cenário proposto?
A comparação com o placebo causa inevitavelmente um viés de
seleção relacionado com a comparação assimétrica entre um
medicamento eficaz e um elemento passivo (ou do qual não se espera
nenhum resultado). Para além disto, esta comparação pode induzir a
uma sobrestimação dos resultados do medicamento em relação ao
objetivo proposto de ser indicado como um elemento que reduz a
presença do evento (neste caso, vómitos) na população e no ambiente
escolhido.
Assim, a correção no modelo entra em conflito com a pertinência a
nível da escolha do modelo de comparação selecionado.
A ferramenta de revisão mais generalizada para os ensaios
clínicos (CONSORT),
ver Imagen 1. Amostra da lista de verificação da informação que é
necessário incluir ao notificar um ensaio clínico aleatorizado, Tradução Imagen 1. Amostra da lista de verificação da informação que é
necessário incluir ao notificar um ensaio clínico aleatorizado
não destaca carências evidentes no artigo.
Imagen 1. Amostra da lista de verificação da informação que é
necessário incluir ao notificar um ensaio clínico aleatorizado

Fonte: CONSORT 2010 http://www.consort-statement.org/
Tabela 2. Tradução Imagen 1. Amostra da lista de verificação da informação que é
necessário incluir ao notificar um ensaio clínico aleatorizado
| Secção/Tópico |
Item N.º |
Itens da lista de verificação |
| Título e Resumo |
|
|
|
1a |
Identificar no título como um estudo clínico
aleatorizado |
|
1b |
Resumo estruturado de um desenho de estudo, métodos,
resultados e conclusões (para orientação específica, consulte
CONSORT para resumos) |
|
Introdução
Fundamentação e
objetivos
|
|
|
|
2a |
Fundamentação científica e explicação do raciocínio |
|
2b |
Objetivos específicos ou hipóteses |
|
Métodos
Desenho do
estudo
|
|
|
|
3a |
Descrição do estudo clínico (ex.: paralelo, fatorial)
incluindo a taxa de alocação |
|
3b |
Alterações importantes nos métodos após ter iniciado o
estudo clínico (ex.: critérios de elegibilidade), com as
razões |
| Participantes |
|
|
|
4a |
Critérios de elegibilidade para participantes |
|
4b |
Informações e locais (centros e instituições) de onde
foram coletados os dados |
| Intervenções |
5 |
As intervenções de cada grupo com detalhes suficientes que
permitam a replicação, incluindo como e quando eles foram
realmente administrados |
| Desfechos |
6a |
Medidas completamente pré-especificadas definidas de
desfechos primários e secundários, incluindo como e quando
elas foram avaliadas |
|
6b |
Quaisquer alterações nos desfechos após o estudo clínico
ter sido iniciado, com as razões |
|
Tamanho da
amostra
|
7a |
Como foi determinado o tamanho da amostra |
|
7b |
Quando aplicável, deve haver uma explicação de qualquer
análise intermédia e diretrizes de encerramento |
| Aleatorização |
|
|
|
Geração da
sequência
|
8a |
Método utilizado para geração de sequência aleatorizada de
alocação |
|
8b |
Tipos de aleatorização, detalhes de qualquer restrição
(tais como aleatorização por blocos e tamanho do bloco) |
|
Mecanismo
de ocultação da
alocação
|
9 |
Mecanismo utilizado para implementar a sequência de
alocação aleatorizada (como
recipientes numerados sequencialmente), descrevendo os
passos seguidos para a ocultação da sequência até as
intervenções serem atribuídos
|
| Implementação |
10 |
Quem gerou a sequência de alocação aleatorizada, quem
inscreveu os participantes e quem atribuiu as intervenções aos
participantes |
| Ocultação |
11a |
Se realizado, quem foi cegado após as intervenções serem
atribuídas (ex. Participantes, cuidadores, assessores de
resultado) e como |
|
11b |
Se relevante, descrever a semelhança das intervenções |
UMA REFLEXÃO FINAL
A declaração de Helsínquia determina quando se pode utilizar o
placebo na investigação clínica: "Os possíveis benefícios,
riscos, custos e eficácia de qualquer novo procedimento devem ser
avaliados em comparação com os melhores métodos preventivos,
diagnósticos e terapêuticos existentes. Isto não exclui que um
placebo, ou nenhum tratamento, possa ser usado em estudos para os
quais não existem procedimentos preventivos, diagnósticos ou
terapêuticos comprovados."
É bem possível que o ondansetron seja um fármaco de primeira
linha no cenário clínico planeado
(Higgins & Green, 2011),
mas
não é menos certo que a comparação escolhida não é muito feliz.
A escolha destes modelos de comparação não é incomum, mesmo em
estudos de prestígio e de índole internacional. Há um exemplo em que
um título bizarro mostra como esta prática é frequente na literatura
científica. Uma metodologia correta não é suficiente para garantir a
qualidade
(Tomasik et al., 2016)
Ver Imagen 2
Tradução Imagen 2
Tabela 3. Tradução Imagen 2
| Espanhol |
Português |
| Lectura crítica |
Leitura crítica |
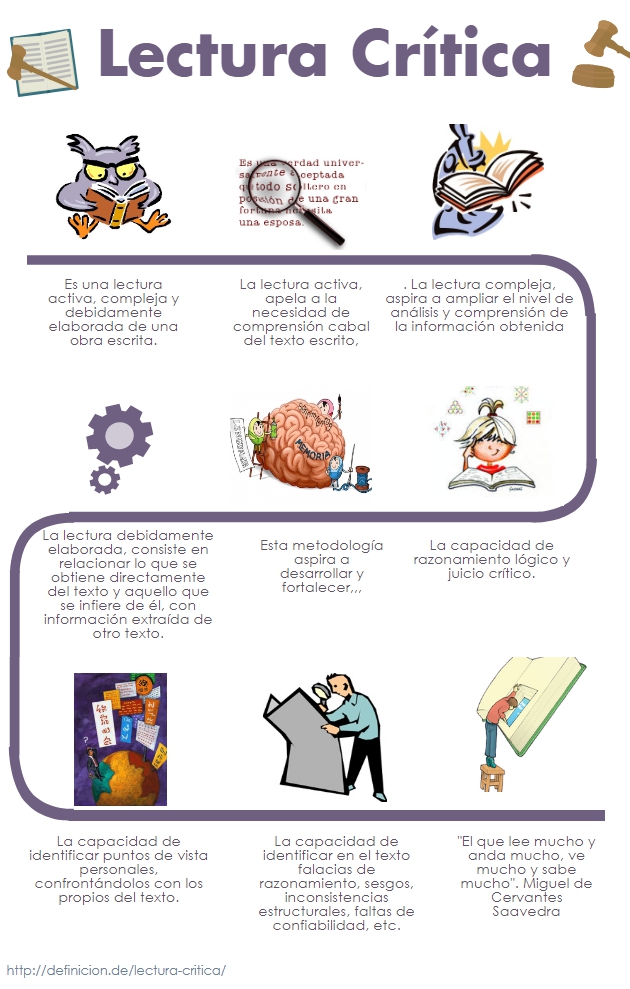
| Es una lectura activa, compleja y debidamente elaborada de
una obra escrita. |
É uma leitura ativa, complexa e devidamente elaborada de
uma obra escrita. |
| La lectura activa apela a la necesidad de comprensión
cabal del texto escrito. |
A leitura ativa apela à necessidade de compreensão cabal
do texto escrito. |
| La lectura compleja aspira a ampliar el nivel de análisis
y comprensión de la información obtenida. |
A leitura complexa visa aumentar o nível de análise e
compreensão da informação obtida. |
| La lectura debidamente elaborada consiste en relacionar lo
que se obtiene directamente del texto y aquello que se infiere
de él, con información extraída de otro texto. |
A leitura devidamente elaborada consiste em relacionar o
que se obtém diretamente do texto e o que se infere do mesmo,
com informação de outro texto. |
| Esta metodología aspira a desarrollar y fortalecer… |
Esta metodologia visa desenvolver e fortalecer… |
| La capacidad de razonamiento lógico y juicio crítico. |
A capacidade de raciocínio lógico e de juízo crítico. |
| La capacidad de identificar puntos de vista personales,
confrontándolos con los propios del texto. |
A capacidade de identificar pontos de vista pessoais,
comparando-os com os do próprio texto. |
| La capacidad de identificar en el texto falacias de
razonamiento, sesgos, inconsistencias estructurales, faltas de
confiabilidad, etc. |
A capacidade de identificar no texto falácias de
raciocínio, vieses, inconsistências estruturais, faltas de
fiabilidade, etc. |
| “El que lee mucho y anda mucho, ve mucho y sabe mucho”.
Miguel de Cervantes Saavedra |
“Aquele que lê muito e anda muito, vê muito e sabe muito”.
Miguel de Cervantes Saavedra |
Ver Imagen 3
Tradução Imagen 3
Imagen 3. Artigo

Table 4. Tradução Imagen 3
| Espanhol |
Português |
| Junio de 2004 |
Junho de 2004 |
| Una comparación putativa con placebo de los ensayos SCOPE
y LIFE. |
Uma comparação putativa com placebo dos ensaios SCOPE e
LIFE. |
No artigo escolhido, também podemos indicar como no final, no
espaço onde são registados os conflitos de interesse e os
agradecimentos, se inclui que o estudo recebeu subvenções, entre
outros organismos, da GlaxoSmithKline, a empresa que desenvolveu a
molécula, sob o nome comercial de Zofran®.
Assim, o uso de ondansetron para o quadro clínico proposto
exigiria uma revisão na que se comparara a sua eficácia com outros
fármacos, uma vez que existem numerosas alternativas que mostraram
resultados e são seguras e amplamente utilizadas
(Meredith, Murray, & McMurray, 2004)
Ver Image 4
Imagen 4. Recorte





 License Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International
License Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International